![]()
Traducción hecha en
la Universidad de Alcalá de Henares, España
Problemas de Energía, Enzimas y Catálisis
Tutoría del problema 6: Constante de
equilibrio de la ionización del ácido acético.
La constante de equilibrio para la ionización del ácido
acético, es 0.00002. ¿Qué puedes concluir sobre esta reacción? |
Equilibrio químico
La ecuación para la reacción química de este problema describe la ionización del ácido acético. El ácido acético (CH3COOH) puede ionizarse a acetato (CH3COO-) y protón (H+).El balance entre las reacciones en los dos sentidos se conoce como equilibrio químico, que se define como la razón entre la concentración de los productos y de los reactivos en el equilibrio, cuando no se producen mas cambios en las concentraciones de todos ellos, es decir cuando se ha alcanzado el equilibrio.
Para esta reacción,
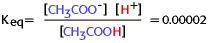
Como la constante de equilibrio es muy pequeña, se puede concluir que casi todo el ácido acético permanece no ionizado, y que la ionización del acético no es espontánea.
Abajo se muestra un resumen de las relaciones entre los valores de la energía libre y la constante de equilibrio químico para el caso en que las reaciones sean espontáneas o no sean espontáneas:
Reacción espontánea Reacción no espontánea Keq > 1 Keq< 1 G < 0
G > 0
Exergónica Endergónica Reaccion directa favorecida Reacción inversa favorecida
Ionización del ácido acético
Esta es una reacción no espontánea que comienza con el ácido acético.
Problema 6 | Respuesta | Problema 7
El Proyecto Biológico > Bioquímica > Energía, Enzimas y Catálisis
El Proyecto Biológico
Department of Biochemistry and Molecular Biophysics
University of Arizona
October 1996
Traducido: Mayo 2004
Contact the Development Team
http://www.biologia.arizona.edu
All contents copyright © 1996-2004. All rights reserved.