![]()
Traducción hecha en las Universidades de Valladolid y de Alcalá de Henares, España
Problemas de ácidos y bases
Problema 1: el agua como disolvente
Tutoría para ayudar a responder el problema
¿Cuáles de las siguientes propiedades del agua explican su capacidad para disolver el ácido acético?
A. La alta tensión superficial del agua, que es debida a la formación de enlaces de hidrógeno entre moléculas de agua adyacentes. B. La capacidad para actuar como tampón, absorbiendo los protones cedidos por el ácido acético. C. La capacidad para orientar las moléculas de agua de manera que sus polaridades neutralicen los iones formados cuando el ácido se disocia. D. La capacidad para formar enlaces de hidrógeno con los grupos carbonilo e hidroxilo del ácido acético.
Tutoría
Agua, el principal disolvente biológico|
El agua puede estabilizar las formas ionizadas de las moléculas, como Na+, Cl-, K+, Mg+2, Ca+2, SO4-2, PO4-2 y HCO3-. Las moléculas de agua adyacentes a un ion simplemente se orientan de forma que sus átomos de oxígeno con carga parcial negativa rodeen a iones positivos, mientras que sus hidrógenos con carga parcial positiva rodeen a iones negativos. Por ejemplo, en la ilustración inferior se muestra el cloruro sódico en su forma cristalina (izquierda) y disuelto en agua (derecha). |
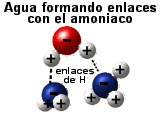
El agua puede formar enlaces de hidrógeno
La capacidad del agua para formar enlaces de
hidrógeno con otras moléculas de agua o con otros
compuestos polares es importante por dos razones:
|
|

|
|
|
Las biomoléculas como glúcidos, proteínas y
ácidos nucleicos que contienen grupos salientes -OH o -NH2 se
parecen a la propia agua o al amoniaco. Esta similitud con el agua o con el
amoniaco permiten al agua formar enlaces de
hidrógeno con estas moléculas, lo que resulta en la
extraordinaria solubilidad de ciertos compuestos en agua (son posibles
disoluciones de sacarosa "100%", es decir, ¡100 g/100 ml!).
Tanto los iones como las moléculas polares se denominan hidrófilos debido a que se solvatan fácilmente en el agua. |
|
Problema 1 | Respuesta | Problema 2
El Proyecto Biológico > Bioquímica > Ácidos y bases
Department of Biochemistry and Molecular Biophysics
The University of Arizona
January 11, 1999
Revised: October 2004
Contact the Development Team
http://www.biology.arizona.edu
All contents copyright © 1999. All rights reserved.
